Oncología: trasplante alogénico (quimeras)
Según la Sociedad Española de Oncología Médica, el cáncer derivado de las células sanguíneas (incluyendo leucemias, linfomas y mielomas) causó más de 8000 muertes en España durante el año 2020. La existencia de tratamientos eficaces es esencial para disminuir estas tasas. Una de las opciones de tratamiento curativo para este tipo de pacientes es el trasplante alogénico.
¿En qué consiste un trasplante alogénico?
Un trasplante alogénico consiste en traspasar células madre obtenidas de un donante sano al paciente oncológico para tratar de restaurar el sistema inmunológico del mismo. El donante debe ser compatible genéticamente con el receptor, por ello en la mayoría de los trasplantes el donante es un familiar del paciente. En muchas ocasiones, se utilizan los registros de donantes para encontrar la compatibilidad adecuada mediante la tipificación de tejidos, proceso de clave para que el tratamiento sea exitoso. En los últimos años, este tratamiento se emplea cada vez más en pacientes oncológicos que sufren cánceres derivados de las células sanguíneas, tanto en adultos como en pacientes pediátricos.
En el alotrasplante, la transferencia de células madre ocurre después de que el paciente pase por un proceso de acondicionamiento. Esta intervención consiste en recibir un tratamiento de quimioterapia o radiación de alta intensidad, cuyo objetivo es eliminar la totalidad de las células cancerígenas y debilitar al sistema inmune del paciente. Este “apagado” del sistema inmunológico permite que las células del donante no sean rechazadas y puedan viajar hasta la médula ósea, lugar donde permitirán la generación de nuevas células sanguíneas basadas en la nueva línea celular del donante sano. Esta fase es conocida como “injerto”.
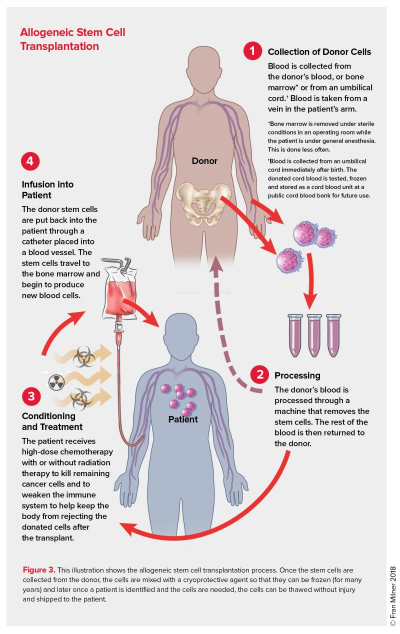
Figura 1. Proceso de recolección e infusión de células madre en un alotrasplante. Figura de Leukemia and Blood and Lymphoma Society. Marrow Stem Cell Transplantation. Revised 2018.
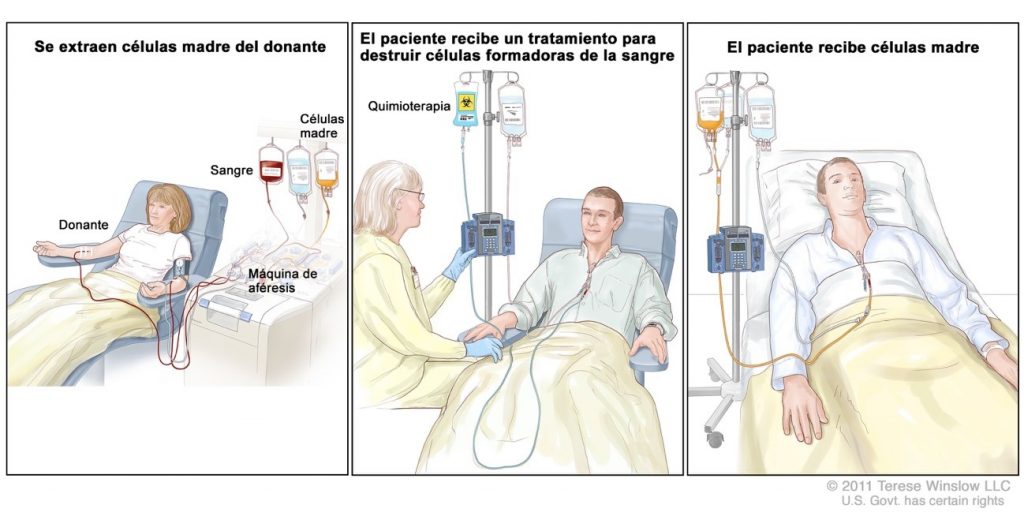
Figura 1. Proceso de recolección e infusión de células madre en un alotrasplante.
Uno de los beneficios exclusivos del alotrasplante de células madre es que, después de que las células del donante se injerten en el paciente, el sistema inmunitario regenerado es capaz de atacar y eliminar cualquier célula cancerosa que quede dispersa en el paciente. Esta capacidad única se denomina “efecto injerto contra tumor”, y puede ser incluso más importante que el régimen de acondicionamiento intensivo. Este efecto no ocurre, por ejemplo, cuando se realiza un autotrasplante, pues en este tipo de tratamiento se utilizan células madre del propio cuerpo del paciente. Otro de los beneficios adicionales de esta terapia es que, en la mayoría de las ocasiones, se puede volver a solicitar al donante la donación de más células madre sanas si el paciente lo necesita, resultando ser un proceso fácilmente programable y recurrente.
¿Cómo de efectivo es este tipo de tratamiento?
Cuando un trasplante alogénico tiene éxito, las células madre del donante consiguen generar un sistema inmune idóneo en el paciente y asegurar su supervivencia. Sin embargo, existen varias limitaciones asociadas a este tratamiento que hacen que la tasa de éxito no sea la deseada.
Una de las contraindicaciones de este tipo de tratamiento es que el paciente sea mayor o que su estado de salud sea realmente crítico, ya que estos pacientes no toleran fácilmente el régimen intenso de acondicionamiento previo. Como alternativa, este tipo de pacientes pueden recibir un trasplante alogénico de intensidad reducida, en el que se emplean dosis más bajas y menos tóxicas de quimioterapia y/o irradiación corporal total (TBI) antes del procedimiento de trasplante. Por otro lado, el hecho de que en el paciente coexistan dos poblaciones genéticamente distintas da como resultado la presencia de quimeras biológicas. Esto significa que, mientras que las células hematopoyéticas circulantes del paciente y sus derivados tisulares se convierten en el genotipo del donante sano, otras células siguen perteneciendo al receptor en su origen. Esta formación no fisiológica de quimeras biológicas no está exenta de consecuencias.
Como la gran mayoría de procedimientos médicos invasivos, en el trasplante alogénico existe la posibilidad de que el resultado no sea el esperado. Una de las causas del fracaso del tratamiento es que el sistema inmune del paciente, a pesar del régimen de acondicionamiento, rechace las células madre del donante antes de que puedan injertarse en la médula ósea. Igualmente, también puede suceder que las células inmunitarias del donante ataquen a las células sanas del cuerpo del paciente. Esto se denomina «enfermedad de injerto contra huésped«.
¿Cómo se realiza el seguimiento clínico del paciente?
La detección temprana de la recaída y el control de los niveles de injerto son un aspecto crítico en el seguimiento del alotrasplante. El nivel de injerto se puede controlar mediante la determinación del genotipo de origen de las células madre o el análisis de quimerismo. Estos análisis permiten conocer el porcentaje de quimerismo del alotrasplante, lo que permite medir o detectar a tiempo si se produce una recaída de la enfermedad. Además, la disminución del quimerismo del donante puede ser el primer signo de falla del injerto. En la siguiente tabla se muestran los diferentes estados de quimerismo y su significado clínico.
| Estado de quimerismo | Definición | Observaciones |
| Quimerismo completo (QC) | Todas las células hematopoyéticas son del donante original | Por lo general, se define como > 95-99,9 % del origen del donante de células hematopoyéticas según la sensibilidad de la prueba (% > límite de detección para el análisis elegido) |
| Quimerismo mixto (QM) | Presencia de células hematopoyéticas del donante y del receptor. | – |
| Quimerismo dividido | QC se ha logrado en uno o más linajes celulares, pero QM todavía existe en otros linajes celulares. | – |
| Injerto | El primero de 3 días consecutivos con recuento absoluto de neutrófilos (RAN) >500/µL (de origen donante) | Injerto plaquetario: recuento sostenido de plaquetas >20.000/µL durante 7 días sin transfusión |
| Fallo primario del injerto | Ausencia de injerto/recuperación hematológica con células de donante en el primer mes post-TPH |
RAN<500/µL día + 28. Se requiere confirmación de falla del injerto mediante análisis de quimerismo |
| Fallo secundario del injerto | Pérdida de la función del injerto (RAN < 500/µL) después del injerto inicial | Quimerismo del donante >5%. Sin causa secundaria como recidiva, infección, toxicidad medular… |
| Recuperación autóloga | 100% origen receptor de células hematopoyéticas |
Tabla 1. Tabla traducida de Delie A et al. 2021.
En la actualidad, existen varias técnicas de biología molecular que permiten realizar el análisis de quimerismo. El método más reproducible a nivel experimental es la adquisición de kits comerciales que permiten amplificar SNP conocidos o polimorfismos de inserción/deleción mediante la técnica de PCR cuantitativa en tiempo real (rt-qPCR). Esta técnica tiene una sensibilidad reportada de 0.01-0.1%. Por otro lado, en los casos de trasplante alogénico de sexo no coincidentes, se utiliza con frecuencia la técnica de hibridación in situ fluorescente (FISH), técnica altamente estandarizada, aunque limitada exclusivamente para estos casos. Por último, la PCR fluorescente semicuantitativa de STR sigue siendo el “gold standard” actual para el seguimiento de quimerismo, dado que se trata de una técnica de uso extendido y bien protocolizada, con una alta aplicabilidad, reproducibilidad, rentabilidad, rapidez y nivel de validación clínica. A día de hoy, sigue siendo el método más utilizado para el análisis de quimerismo.
Como conclusión, el trasplante alogénico se presenta actualmente como un tratamiento eficaz para pacientes oncohematológicos. Sin embargo, el seguimiento clínico del paciente es un factor clave para poder controlar el estado del alotrasplante y lograr aumentar las tasas de éxitos de este tipo de tratamiento. Para ello, se recomienda el uso de técnicas vanguardistas de biología molecular en la práctica clínica ya que proporcionan herramientas reproducibles y altamente sensibles para este monitoreo.
Bibliografía
Aldoss I, Clark M, Marcucci G, Forman SJ. Donor derived leukemia in allogeneic transplantation. Leuk Lymphoma. 2021 Dec;62(12):2823-2830. doi: 10.1080/10428194.2021.1929966. Epub 2021 Oct 29. PMID: 34713775.
Delie A, Verlinden A, Beel K, Deeren D, Mazure D, Baron F, Breems D, De Becker A, Graux C, Lewalle P, Maertens J, Poire X, Schoemans H, Selleslag D, Van Obbergh F, Kerre T. Use of chimerism analysis after allogeneic stem cell transplantation: Belgian guidelines and review of the current literature. Acta Clin Belg. 2021 Dec;76(6):500-508. doi: 10.1080/17843286.2020.1754635. Epub 2020 May 2. PMID: 32362204.
Khan F, Agarwal A, Agrawal S. Significance of chimerism in hematopoietic stem cell transplantation: new variations on an old theme. Bone Marrow Transplant. 2004 Jul;34(1):1-12. doi: 10.1038/sj.bmt.1704525. PMID: 15156163.
Leukemia and Blood and Lymphoma Society. Marrow Stem Cell Transplantation. Revised 2018.
Sociedad Española de Oncología Médica (SEOM). Las cifras del cáncer en España 2022. ISBN: 978-84-09-38029-9.
Themeli M, Waterhouse M, Finke J, Spyridonidis A. DNA chimerism and its consequences after allogeneic hematopoietic cell transplantation. Chimerism. 2011 Jan;2(1):25-8. doi: 10.4161/chim.2.1.15276. PMID: 21547035; PMCID: PMC3084955.
