
Biopsia líquida: huyendo de los estudios invasivos
Introducción
Tradicionalmente, la oncología y la anatomía patológica han sido dos disciplinas íntimamente ligadas: la primera dependía (y, en múltiples ocasiones, lo sigue haciendo) de la segunda para poder dar un diagnóstico preciso. Así, la observación microscópica de la biopsia sólida permitía afirmar, con total certeza, sobre el tipo de tumor que había desarrollado el paciente y, de este modo, el oncólogo era capaz de tomar decisiones terapéuticas. Este procedimiento requería, entre otras acciones, la intervención quirúrgica del paciente que, dependiendo de donde tuviera el tumor, podría verse expuesto a un menor o mayor riesgo de complicaciones durante el proceso. Pero, ¿y si fuera posible responder las clásicas preguntas del oncólogo (tipo de tumor, estadio, tratamiento más efectivo para el mismo) sin la necesidad de realizar una biopsia? Esta solución ya está siendo investigada en laboratorios de todo el mundo y se denomina biopsia líquida.
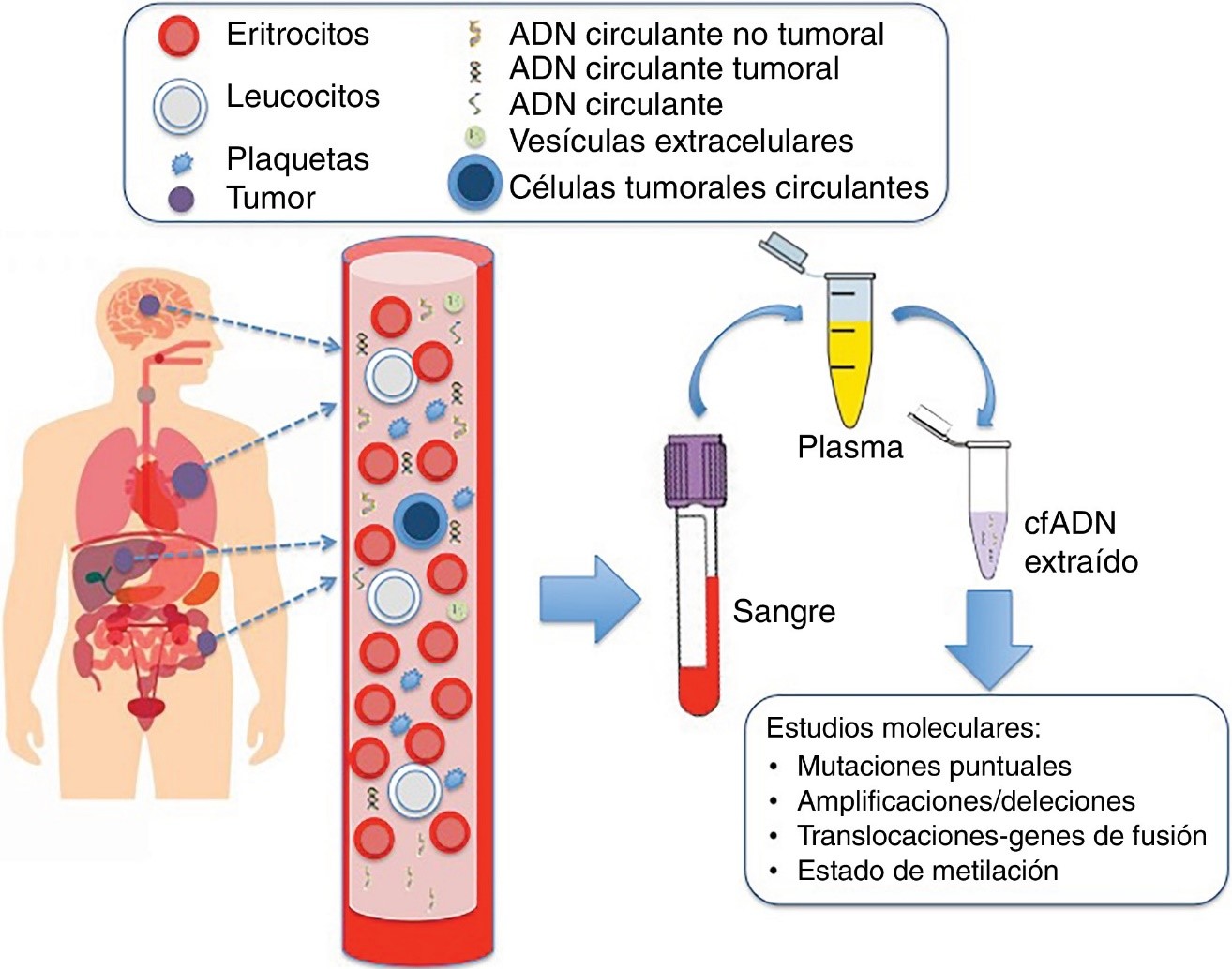
Imagen 1. Representación esquemática de la biopsia líquida (Álvarez-Alegret y colaboradores, 2020).
Conceptos básicos
La biopsia líquida es el análisis molecular de fluidos corporales (sobre todo, sangre y orina) en busca de información clínicamente relevante. El uso más extendido de la misma en la actualidad tiene lugar en el área médica de la oncología: se analizan muestras de sangre para identificar moléculas de ADN procedentes del tumor con información sobre su estadio, pronóstico y posibilidades diagnósticas. De este modo, el oncólogo puede abordar el caso clínico del paciente desde la medicina personalizada. Este análisis se centra en diferentes marcadores:
- ADN circulante (Cell-free DNA o cfDNA): material genético liberado al torrente sanguíneo. Puede proceder, o no, de las células tumorales
- ADN circulante tumoral (Circulating tumor DNA o ctDNA): material genético liberado al torrente sanguíneo por las células tumorales.
- Células tumorales circulantes (Circulating tumor cells o CTCs): células que migran del tumor para viajar por el torrente sanguíneo con el objetivo de iniciar una metástasis tumoral.
La tabla 1, traducida de Nikanjam y colaboradores (2022) muestra claramente las diferencias entre los distintos tipos de muestra.
| ctDNA/cfDNA | CTCs | |
| Facilidad de obtención | Más fácil | Más difícil |
| Posibilidad de cultivo | No | Sí |
| Predicción de respuesta terapéutica | Sus cambios predicen respuesta/resistencia/recaída | Sus cambios pueden predecir respuesta/resistencia/recaída |
| Posibilidad de evaluar datos Genómicos/Transcriptómicos/Proteómicos | Puede analizarse el ADN | Puede analizarse el ADN, ARN y las proteínas |
| Posibilidad de evaluar datos funcionales | No | Sí |
| Posibilidad de evaluar metilación | Sí | Sí |
| Posibilidad de realizar un análisis de hibridación por fluorescencia in situ | No | Sí |
| Posibilidad de realizar un análisis de una sola célula (single cell analysis) | No | Sí |
| Posibilidad de realizar un análisis cromosómico | No | Sí |
| Desafíos en la toma de muestra/interpretación de resultados |
– La muerte celular por la terapia puede modificar los niveles de ctDNA – Las pequeñas cantidades de ctDNA circulante pueden confundirse con Hematopoyesis clonal de potencial indeterminado (CHIP) |
– La heterogeneidad de las CTCs puede afectar al análisis – Sesgo en el muestreo de las células aisladas (mayor afinidad y mayor tamaño) |
Tabla 1. Principales diferencias entre la biopsia sólida en ADN circulante (cfDNA), ADN circulante procedente del tumor (ctDNA) y células circulantes procedentes del tumor (CTCs) (Nikanjam et al.2022)
¿Qué diferencias hay con la biopsia sólida?
La biopsia líquida parece haber llegado para quedarse. La idea de poder caracterizar un tumor sin ni siquiera practicar una mínima incisión en el cuerpo del paciente es muy atrayente. Sin embargo, hay que tener en cuenta que, como todas las técnicas diagnósticas, tiene sus limitaciones. La tabla 2, traducida de Poulet y colaboradores (2018), muestra de manera resumida las principales diferencias entre la biopsia sólida y la biopsia líquida.
| Biopsia sólida convencional | Biopsia líquida |
| Técnica de elección (Gold standard) | Interés clínico actualmente en investigación |
| Permite el análisis histológico y la clasificación en estadios | El análisis histológico se limita a las CTCs |
| Podría no estar disponible en determinados casos | Fácil de realizar y con tiempo de entrega de resultados rápido, pero compleja por la poca cantidad de productos derivados del tumor en los fluidos y el riesgo de falsos negativos |
| Procedimiento invasivo e incómodo para los pacientes (puede acarrear complicaciones clínicas) | Mínimamente invasivo |
| Los tejidos preservados en parafina (FFPE) pueden presentar una calidad del ADN muy variable (reticulación o crosslinking del ADN) dependiendo de la obtención, almacenamiento y preservación | El ADN fresco no se ve modificado, aunque deben respetarse estrictos procedimientos de recolección, manipulación y almacenamiento de la muestra para evitar la degradación del ADN |
| Aunque depende del método de muestreo, potencialmente, se puede obtener una alta concentración de ADN; riesgo de degradación/cross-linking (FFPE) | La concentración y calidad del ADN depende mucho del procesamiento pre-analítico y analítico |
| Análisis localizado, que no permite la caracterización de la heterogeneidad inter o intratumoral (metástasis), sobre todo en estadios avanzados o múltiples localizaciones del tumor | Permite, en principio, determinar la heterogeneidad inter e intratumoral y en múltiples localizaciones del tumor, siempre que se pueda extraer suficiente cantidad de ADN. |
| No aplicable en el monitoreo seriado del paciente; análisis en momentos concretos (tiempos de muestreo fijos); no permite el seguimiento dinámico de las modificaciones moleculares del cáncer | Permite el monitoreo seriado del paciente; el ADN se puede extraer en cualquier momento durante el seguimiento terapéutico; permite el seguimiento dinámico del tumor (sobre todo, aquella modificaciones vinculadas al ctDNA de corta vida media en circulación) |
Tabla 2. Principales diferencias entre la biopsia sólida tradicional y la biopsia líquida (Poulet et al. 2018).
Como se puede apreciar, las principales limitaciones de la biopsia líquida obedecen a la poca cantidad de marcadores moleculares específicos del tumor en cáncer con respecto a otras células y moléculas propias del paciente. Sin embargo, la facilidad de la toma de la muestra unida a la posibilidad de monitorizar el avance del tumor en tiempo real, hacen de la biopsia líquida una técnica esperanzadora en el campo de la oncología médica.
Principales aplicaciones de la biopsia líquida
La biopsia líquida está siendo estudiada para el apoyo en el diagnóstico y tratamiento de tumores a múltiples niveles. Por ejemplo, esta técnica está resultando especialmente útil en la identificación de patrones de respuesta favorable a la inmunoterapia. Es habitual el uso de inhibidores de los puntos de control (Checkpoints) del sistema inmune, con el objeto de potenciar las defensas del paciente frente a las células tumorales. De este modo, se estudian tanto el cfDNA como las ctDNA para fenotipar el tumor en busca de patrones de respuesta a la inmunoterapia como el Ligando 1 de muerte celular programada (PD-L1), investigado, entre otros, por Guibert y colaboradores (2018). Otro ejemplo concreto es la investigación del grupo de Ricciuti y colaboradores (2021), que identificaron en pacientes de carcinoma pulmonar no microcítico tratados con pembrolizumab±platinum/pemetrexed una correlación inversa estadísticamente significativa entre el porcentaje de ctDNA circulante y la tasa de respuesta a la terapia. Lo mismo ocurrió con la correlación entre dicho porcentaje y la tasa de supervivencia de los pacientes.
¿Cuáles son las técnicas necesarias para el estudio de una biopsia líquida?
Como se mencionaba con anterioridad, los procedimientos de extracción, almacenamiento y preservación de la muestra son cruciales para un estudio preciso de biopsia líquida; pero es más determinante aún la técnica molecular empleada para ello. En lo que respecta al análisis de material genético (cfDNA y ctDNA), es tremendamente relevante apostar por una técnica de análisis lo suficientemente precisa y sensible para detectar los bajos niveles que se encuentran de estos marcadores en sangre. Así, los secuenciadores de última generación (NGS) y la PCR digital (digital droplet PCR o ddPCR) se han convertido en un poderoso aliado en los laboratorios diagnósticos de hospitales de todo el mundo. El artículo de Postel y colaboradores (2018) repasa con detalle la aplicación técnica de ambas, así como sus pros y contras.
Teniendo en cuenta los avances científicos que actualmente tienen lugar en este campo, se puede concluir que la biopsia sólida es ya una realidad como herramienta diagnóstica, pronóstica y de evaluación de la respuesta terapéutica en diversas áreas clínicas, pero con un futuro especialmente prometedor en la oncología. Esto se debe a que, a diferencia de otras afecciones como las enfermedades infecciosas, el diagnóstico y tratamiento clásicos se han basado en procedimientos invasivos y de un elevado riesgo para el paciente que deben ser sustituidos a la mayor brevedad posible. Por tanto, la biopsia líquida supone un salto cualitativo en la oncología, acercándola más a la medicina personalizada.
Fuentes:
Álvarez-Alegret, R., Rojo Todo, F., Garrido, P., Bellosillo, B., Rodríguez-Lescure, Á., Rodríguez-Peralto, J. L., Vera, R., de Álava, E., García-Campelo, R., & Remon, J. (2020). [Liquid biopsy in oncology: A consensus statement of the Spanish Society of Pathology and the Spanish Society of Medical Oncology]. Revista Espanola de Patologia : Publicacion Oficial de La Sociedad Espanola de Anatomia Patologica y de La Sociedad Espanola de Citologia, 53(4), 234–245. https://doi.org/10.1016/J.PATOL.2019.12.001
Guibert, N., Delaunay, M., Lusque, A., Boubekeur, N., Rouquette, I., Clermont, E., Mourlanette, J., Gouin, S., Dormoy, I., Favre, G., Mazieres, J., & Pradines, A. (2018). PD-L1 expression in circulating tumor cells of advanced non-small cell lung cancer patients treated with nivolumab. Lung Cancer (Amsterdam, Netherlands), 120, 108–112. https://doi.org/10.1016/J.LUNGCAN.2018.04.001
Nikanjam, M., Kato, S., & Kurzrock, R. (2022). Liquid biopsy: current technology and clinical applications. Journal of Hematology & Oncology, 15(1). https://doi.org/10.1186/S13045-022-01351-Y
Postel, M., Roosen, A., Laurent-Puig, P., Taly, V., & Wang-Renault, S. F. (2018). Droplet-based digital PCR and next generation sequencing for monitoring circulating tumor DNA: a cancer diagnostic perspective. Expert Review of Molecular Diagnostics, 18(1), 7–17. https://doi.org/10.1080/14737159.2018.1400384
Poulet, G., Massias, J., & Taly, V. (2019). Liquid Biopsy: General Concepts. Acta Cytologica, 63(6), 449–455. https://doi.org/10.1159/000499337
Ricciuti, B., Jones, G., Severgnini, M., Alessi, J. V., Recondo, G., Lawrence, M., Forshew, T., Lydon, C., Nishino, M., Cheng, M., & Awad, M. (2021). Early plasma circulating tumor DNA (ctDNA) changes predict response to first-line pembrolizumab-based therapy in non-small cell lung cancer (NSCLC). Journal for Immunotherapy of Cancer, 9(3). https://doi.org/10.1136/JITC-2020-001504
